Jumeaux et STT
Traitement par Laser sous Fœtoscopie du syndrome transfuseur-transfusé ou d’un TAPS.
Protocole de prise en charge
R Favre & AS. Weingertner
Département de Médecine fœtale, CMCO, CHU Strasbourg, France
Centre de compétence STT
Téléphone d'astreinte : 06 68 53 94 32
Téléphone secrétariat de Médecine foetale: 03 69 55 34 15
03 69 55 34 45
03 69 55 34 44
03 69 55 34 59
Mail : Romain Favre :

Anne-Sophie Weingertner :

Nicolas Sananes :

1. Introduction
Les grossesses gémellaires monochoriales (les vrais jumeaux) peuvent se compliquer d’un syndrome transfuseur-transfusé (STT) ou d’un TAPS (séquence fœtus anémique et fœtus polycythémique). Il s’agit d’un transfert de fluide d’un des jumeaux (le donneur) vers l’autre (le receveur) à travers des vaisseaux communs aux 2 jumeaux (anastomoses) qui traversent la masse placentaire. Pour le TAPS, il s'agit d'un transfert de sang (figure 1).
Figure 1. Anastomose artério-veineuse sous endoscopie.

Cette complication survient chez environ 10 % des grossesses monochoriales, le premier symptôme est la croissance excessive de la taille de l’utérus et un inconfort maternel important. Ceci est lié à l’excès de liquide amniotique chez le receveur. En l’absence de traitement, malheureusement la grossesse va s‘interrompre dans la majorité des cas, soit à cause du décès de l’un ou des deux jumeaux ou en raison de la perte des eaux. Dans le TAPS, il n’y a pratiquement aucun symptôme maternel, le diagnostic ne peut se faire qu’avec l’échographie et le Doppler.
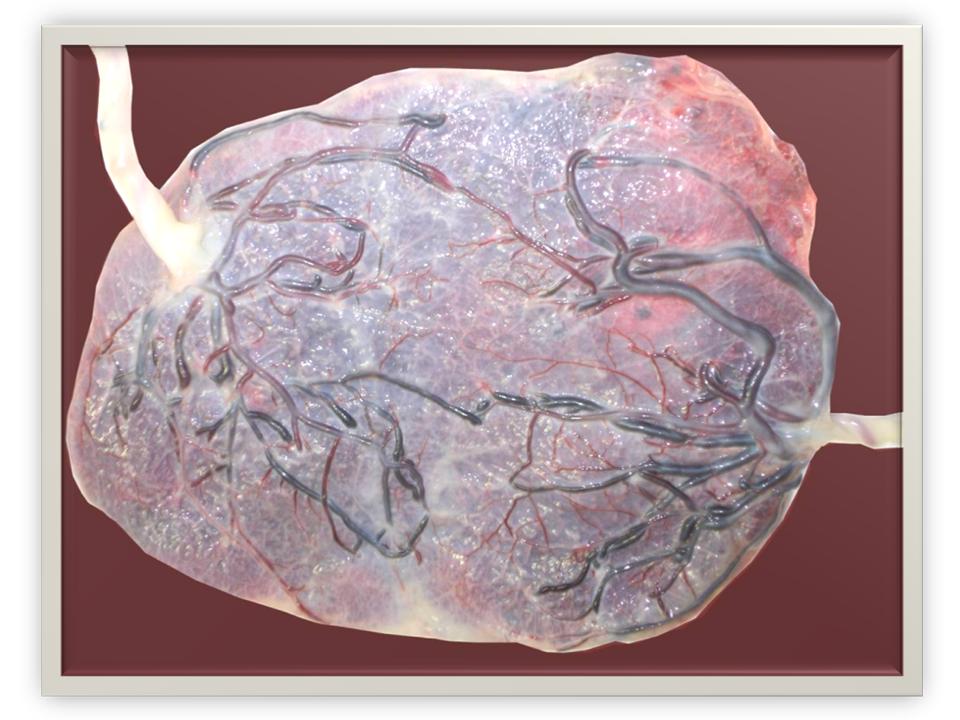
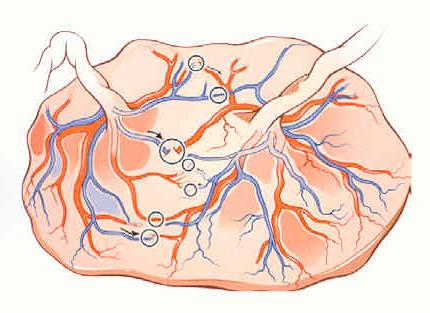
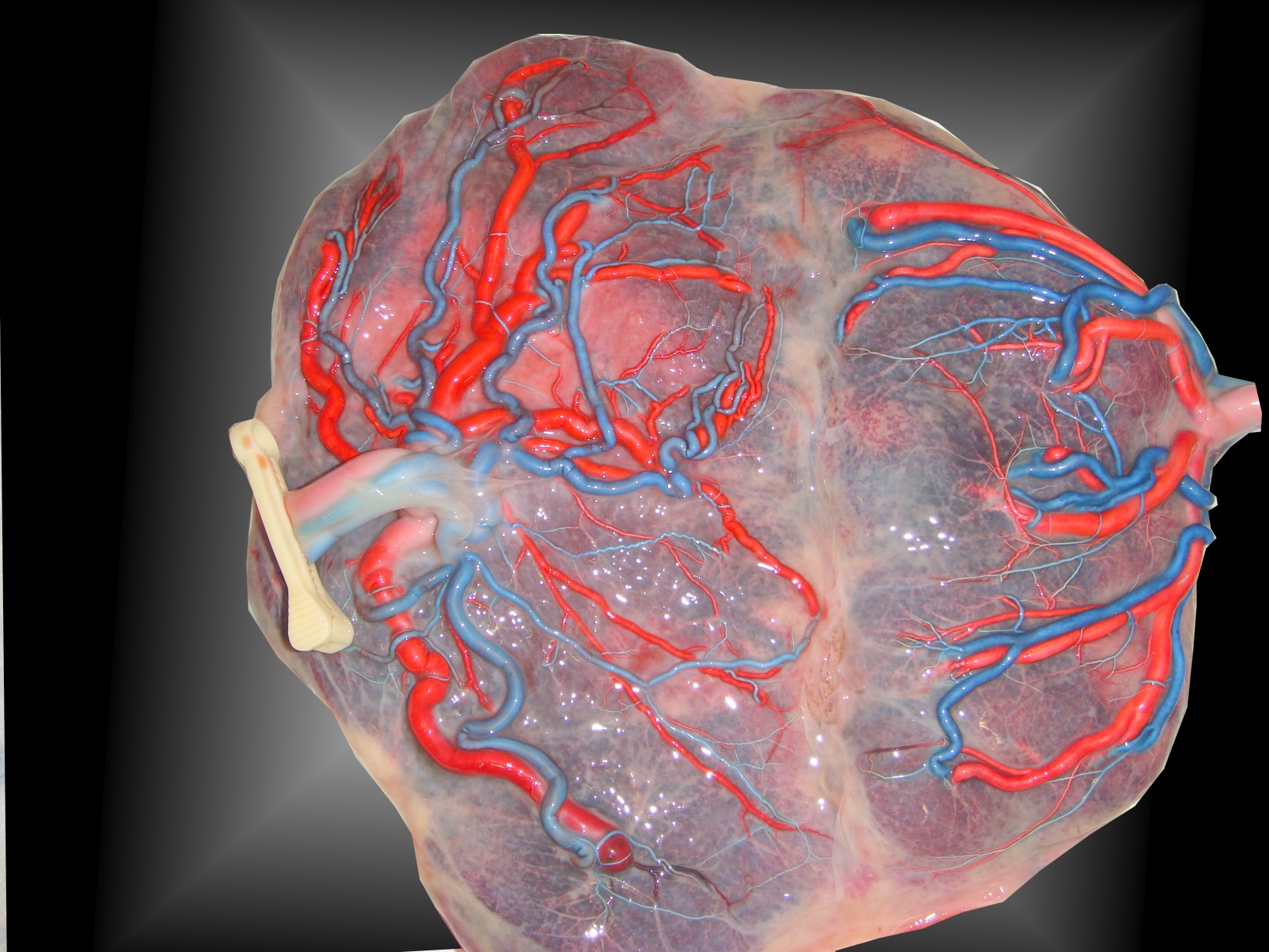
Tous les placentas des vrais jumeaux ont des vaisseaux communs à la surface du placenta, il s’agit d’anastomoses artério-artérielle (AA), veno-veineuse (VV). Ces communications sont protectrices et vont le plus souvent éviter la complication classique du STT(Figure 2.)
Figure 2. Placenta frais avec anastomoses AA et VV.
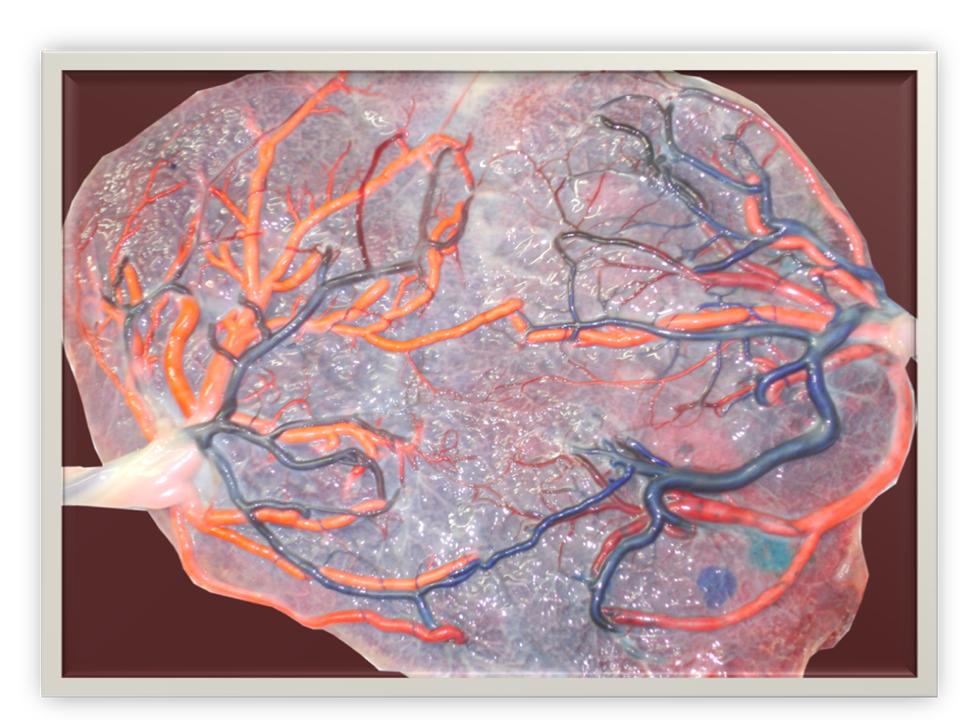
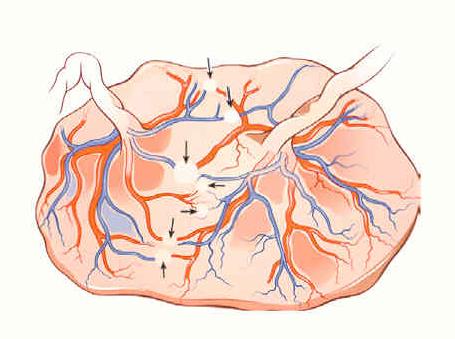
Par contre, on les observe facilement après injection des vaisseaux funiculaires (Figure 3)
Figure 3. Placenta injecté avec anastomoses AA et VV.
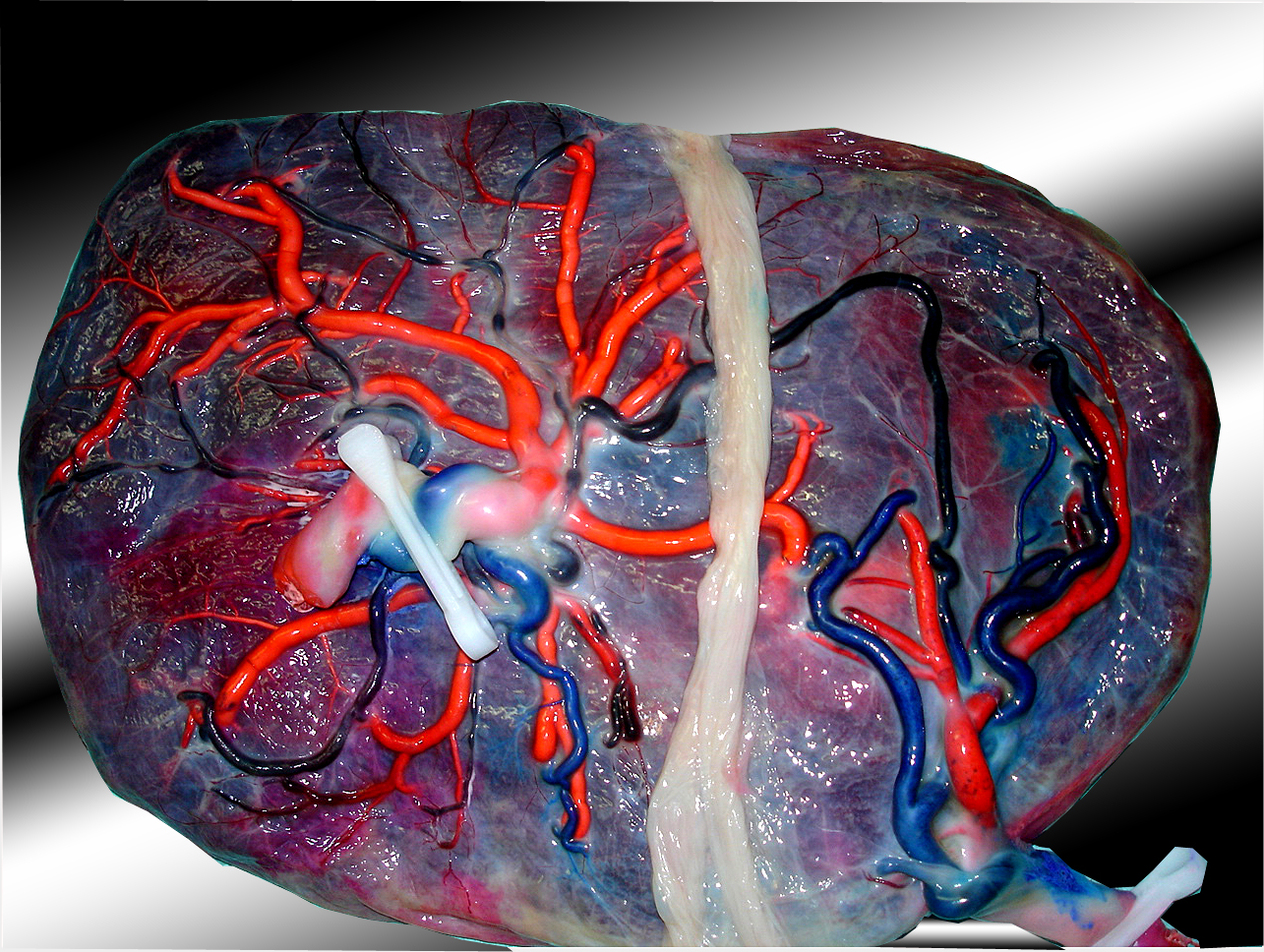
Le STT survient lorsque ce type d’anastomoses est rare ou absente avec présence d’une ou de plusieurs anastomoses artério-veineuses (AV) se dirigeant du donneur vers le receveur à travers la membrane qui les sépare (Figure 4.)
Figure 4. Anastomose artério-veineuse.
Le donneur devient hypovolémique et va diminuer sa production d’urine. C’est ainsi que sa poche devient de plus en plus petite. Le receveur au contraire est en surcharge liquidienne, il essaie de réguler ceci en produisant beaucoup d’urine, ce qui explique l’hydramnios. Il va finalement présenter une insuffisance cardiaque.
Le TAPS présente également des anastomoses mais beaucoup plus fine, telle que l’on peut voir sur la Figure 5.
Figure 5. Anastomose artério-veineuse dans un cas de TAPS.
Le STT est classé en stades avec un pronostic dépendant de cette classification. Elle a été proposée par Ruben Quintero en 2000.
| Stade | Aspect clinique |
|---|---|
| Stade I | Polyhydramnios / Oligoamnios |
| Stade II | Vessie du donneur non visible |
| Stade III | Anomalie Doppler du donneur ou du receveur |
| Stade IV | Anasarque du receveur |
| Stade V | Décès d'un des jumeaux |
Le TAPS dispose d’une même classification proposée par Lopriore.
| Stade | Aspect clinique |
|---|---|
| Stade I | Doppler foetus anémique > 1,5 MoM / Dopler foetus polycythémique < 1 MoM |
| Stade II | Doppler foetus anémique > 1,7 MoM / Dopler foetus polycythémique < 0,8 MoM |
| Stade III | Anomalie Doppler du foetus anémique |
| Stade IV | Anasarque du foetus anémique |
| Stade V | Décès d'un des jumeaux |
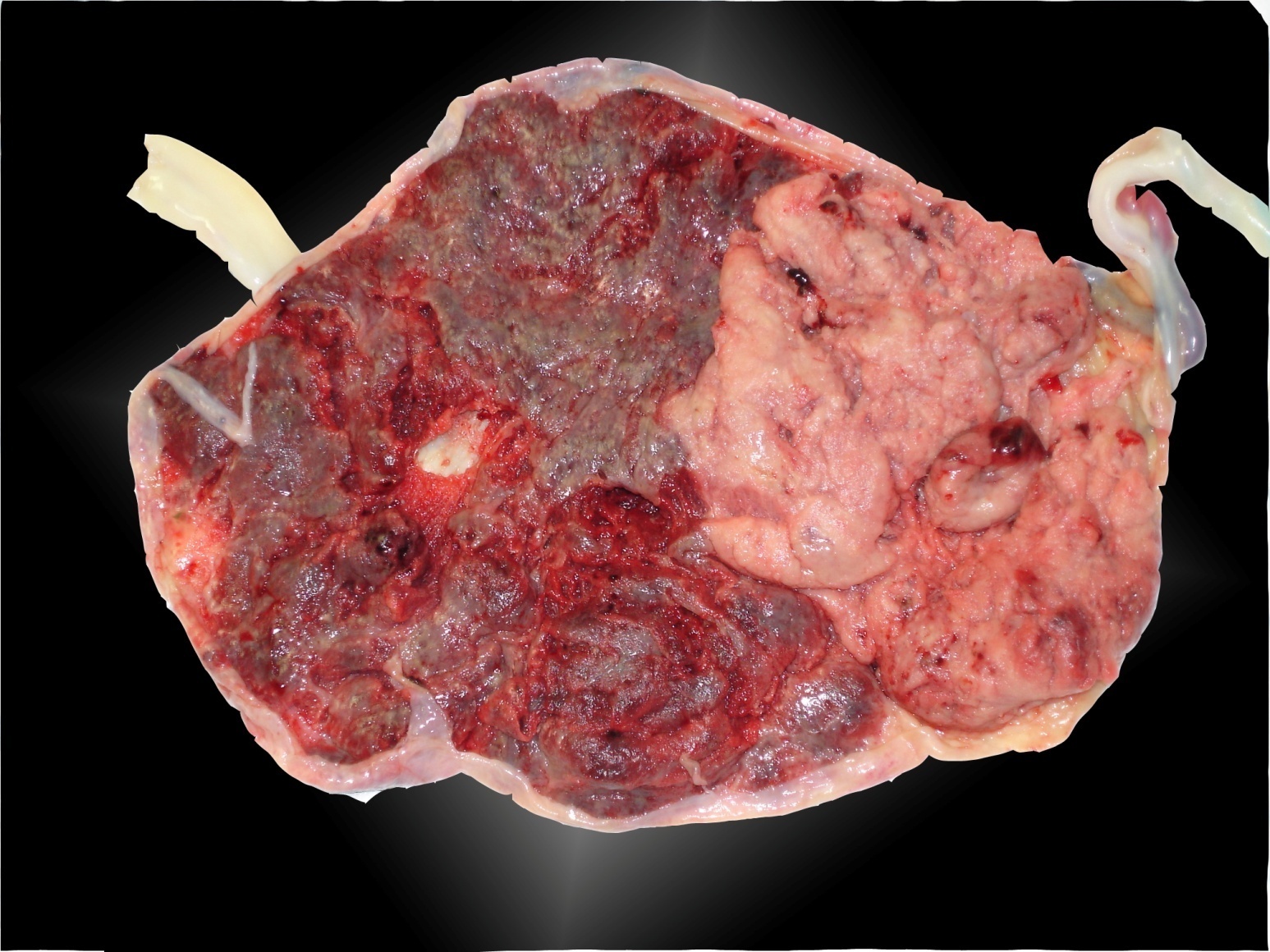
Après la naissance le placenta est typique Figure 6.
Figure 6. Aspect de la face maternelle du placenta dans un cas de TAPS.
Le meilleur traitement actuel de ces deux pathologies de la grossesse gémellaire est la coagulation par Laser de ces anastomoses afin de séparer les deux masses placentaires.
2. Prise en charge médicale.
Ce traitement se fait sous anesthésie locale après prémédication. Vous serez hospitalisée la veille, avec votre conjoint si vous le désirez. Le jour de l’intervention une prémédication est effectuée sur un sucre per os 2 heures avant le geste. Vous aurez une douche avec Bétadine afin d’éviter une complication infectieuse.
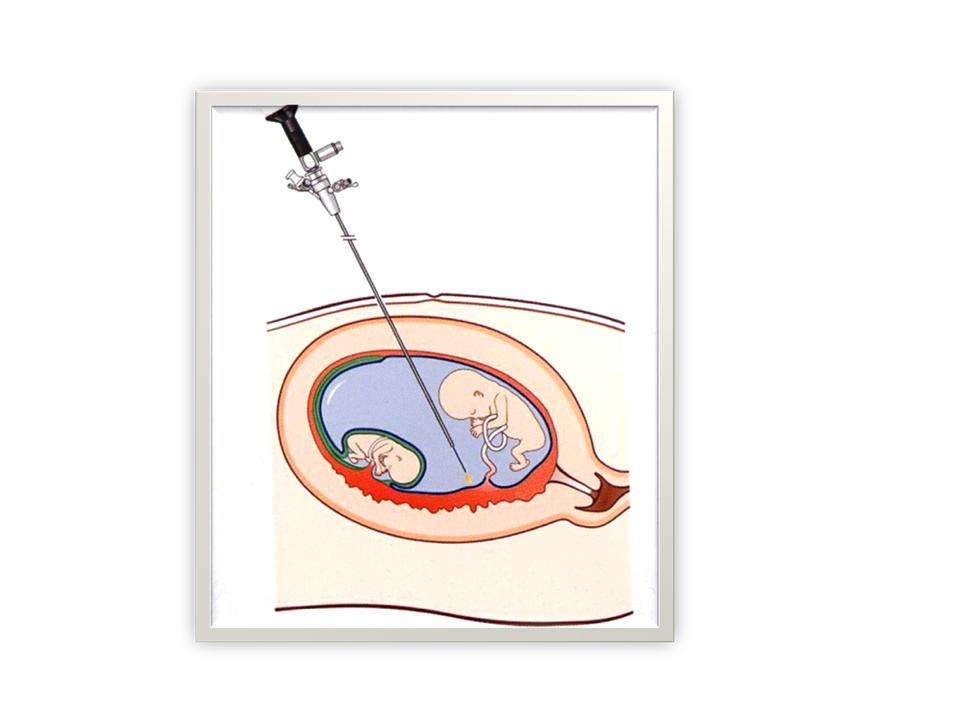
L’intervention a lieu en règle générale en début de matinée. Elle dure en moyenne 30 – 45 minutes. Une perfusion d’antibiotique (Clamoxyl) est utilisée pendant le geste. Après repérage échographique, une désinfection de la paroi abdominale est effectuée. Puis une anesthésie locale par Xylocaïne est réalisée. Le geste est très peu douloureux. Un trocart plastique est introduit dans le sac amniotique du receveur ou du fœtus polycythémique sous contrôle échographique. L’endoscope est inséré dans ce trocart sans aucune douleur. Il permet de suivre la limite entre les deux masses placentaires. Les vaisseaux communs seront coagulés par une très fine fibre Laser (Figure 7). Dans les cas de TAPS, nous ferons une amnio-infusion de 400 – 500 ml afin de repousser la membrane du donneur pour accéder à l’équateur vasculaire.
(Figure 7)(Vidéo).
Figure 7. Fœtoscopie pour STT, aspect placentaire avant et après coagulation au Laser.
En fin de geste, nous allons drainer l’excès de liquide amniotique par le trocart plastique. En moyenne un à 2 litres seront vidangés.
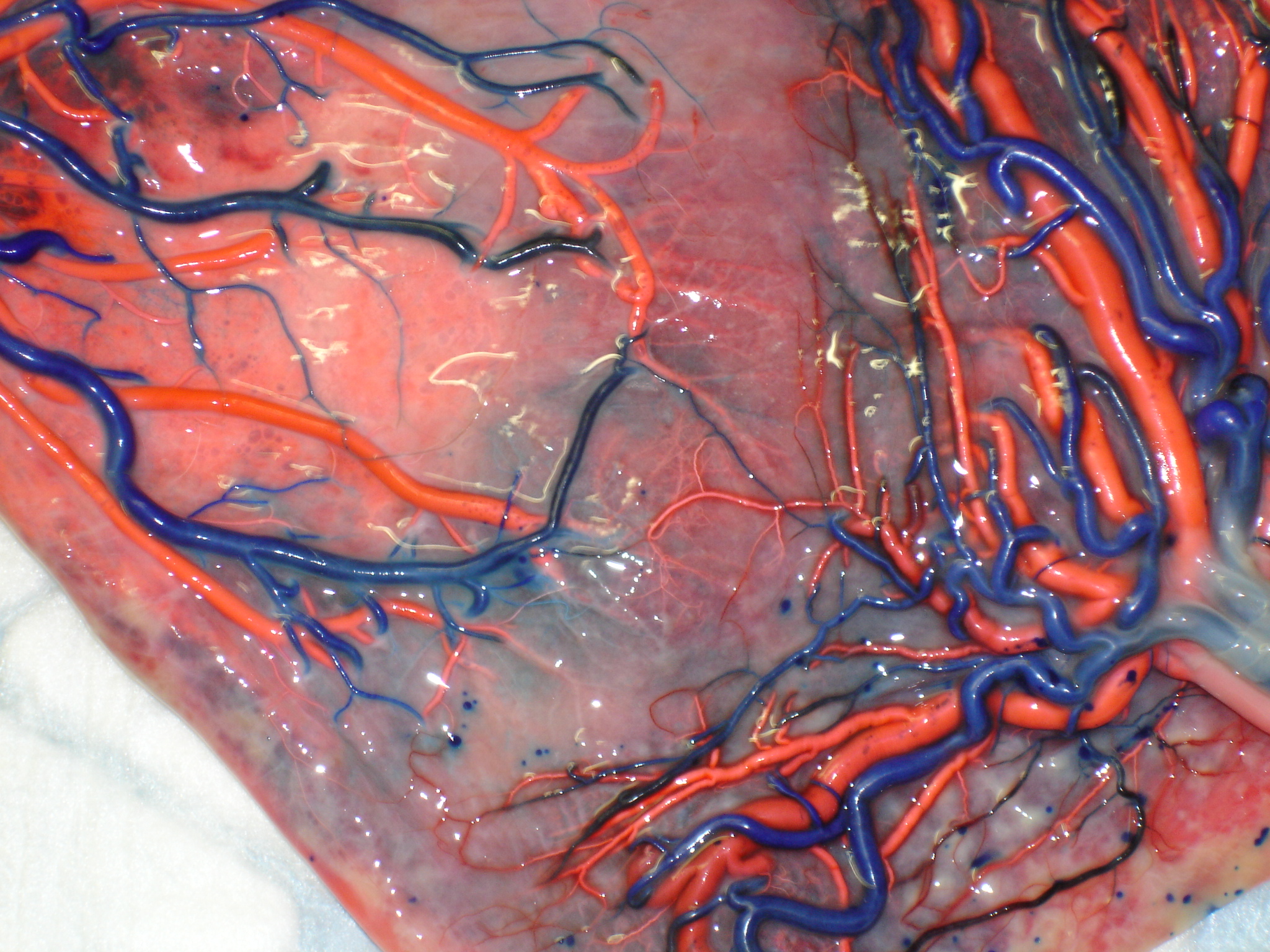
Plusieurs études ont montré que le traitement des STT par Laser n’est pas toujours efficace et que des complications sévères peuvent arriver. Plus d’un tiers des placentas traités par Laser conservent des anastomoses résiduelles. Celles-ci peuvent entraîner différentes complications hématologiques, comme la séquence anémie-polycythémie (TAPS). La plupart des anastomoses résiduelles qu’on retrouve à la naissance sont extrêmement fines (diamètre < 1 mm) et peuvent ne pas être vues durant la fœtoscopie, puisqu’elles sont à ce moment là encore plus fines (Figure 8.)
Figure 8. Aspect de très fines anastomoses après traitement incomplet au Laser.
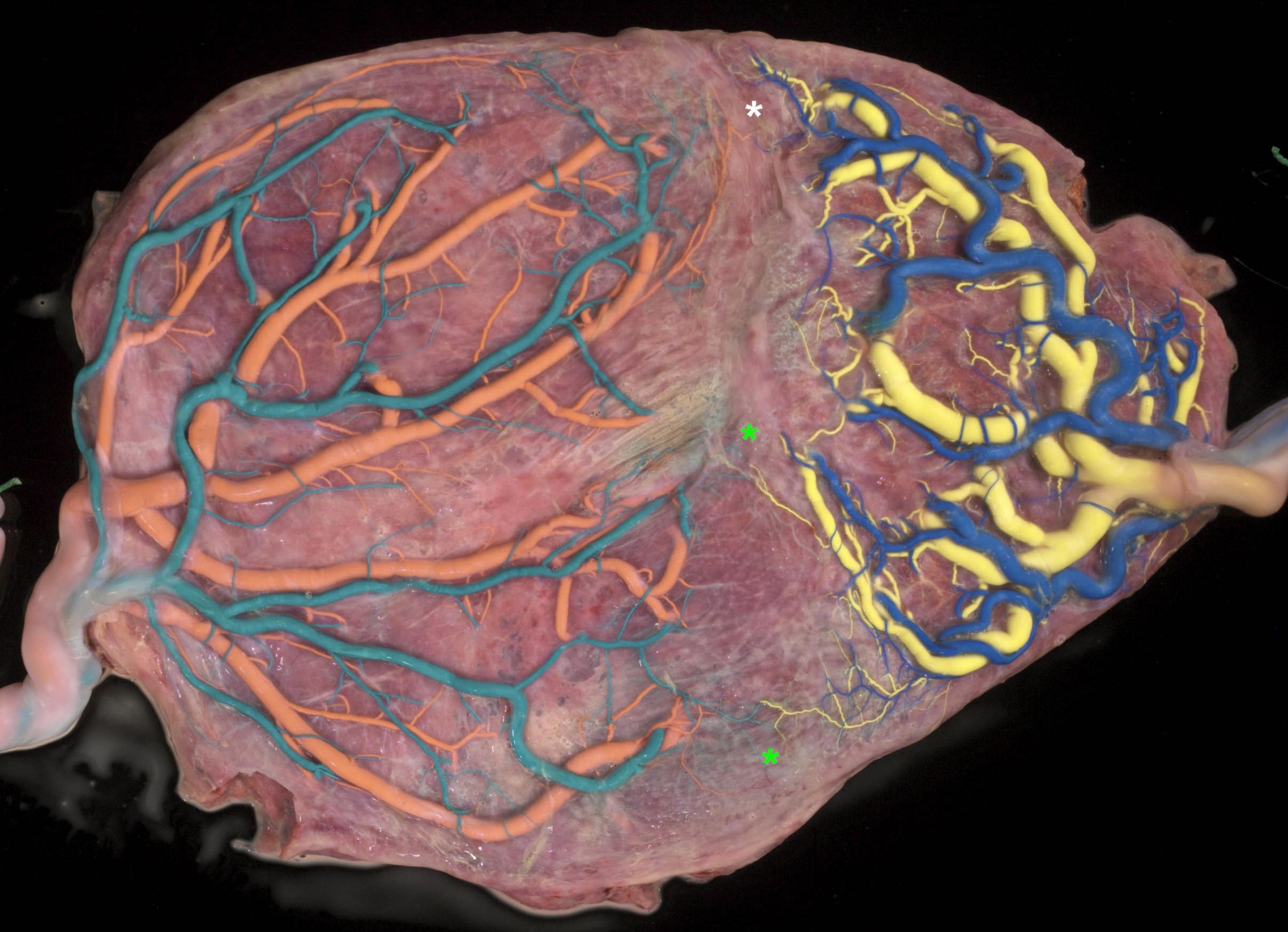
Une solution possible à ce problème est d’adopter une technique de traitement par Laser différente, dans laquelle toute la vascularisation entre les deux portions placentaires serait coagulée et pas seulement les anastomoses. Le but principal de cette méthode est de réduire l’incidence des petites anastomoses résiduelles et donc éviter la survenue d’un TAPS ou d’une récidive d’un STT. L’aspect du placenta en fin de grossesse montre bien cette séparation en deux masses placentaires (Figure 9.)
Figure 9. Aspect placentaire après traitement complet au Laser.
L’objectif est le même en cas de TAPS primitif, il s’agit de séparer les deux placentas
3. Résultats.
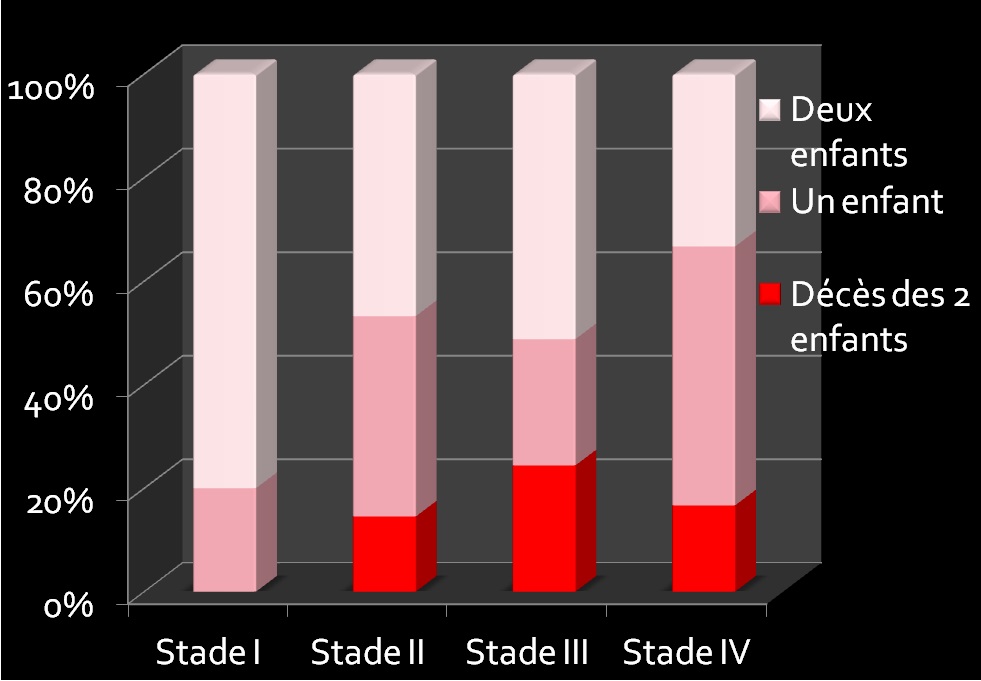
En cas de STT, le taux de double survivants est d’environ 60%, il y aura au moins un survivant dans 85% des cas. (Figure 10.)
Figure 10. Taux de survie en fonction du score de Quintero.
Les résultats en cas de TAPS sont assez similaires.
La complication la plus fréquente est la rupture des membranes, elle survient dans 15 – 20 % des cas. Elle peut se compliquer d’un accouchement prématuré. Parmi ce groupe d’enfants survivants 3 – 5 % risquent de présenter des problèmes neuro-développementaux ultérieurs. Un suivi vous sera proposé.
Dans les séries les plus importantes 10- 15 % des patientes vont présenter une récidive ou un TAPS dans les suites. Ceci peut nécessiter une nouvelle intervention. Cette complication est liée à la difficulté de réaliser un geste complet sur toute la surface placentaire. Ce risque paraît plus faible après coagulation sur l’ensemble de l’équateur vasculaire. Notre taux de TAPS secondaire est de 3 %, nettement plus faible que ce que décrit la littérature, car nous utilisons la technique de Solomon qui sépare les deux placentas.
Votre hospitalisation devrait durer quelques jours. Un contrôle échographique est effectué le lendemain du geste ainsi que le surlendemain.
A priori le retour à domicile est possible 2 jours après l’intervention. La suite de la grossesse implique un repos maximal. Un contrôle est effectué chez votre médecin de manière hebdomadaire pendant les premiers temps.
L’accouchement est habituellement planifié vers 34 – 35 semaines en fonction de la qualité du résultat initial. Cet accouchement a habituellement lieu dans une maternité permettant une prise en charge adéquate de votre enfant. Un certain nombre d’examens seront effectués par l’équipe pédiatrique.
Il nous importe beaucoup de pouvoir analyser le placenta après l’accouchement afin de vérifier la qualité du geste chirurgical.
Nous vous ferons parvenir de manière annuelle un questionnaire d’évaluation du développement de votre enfant.
N’hésitez pas à nous poser toutes les questions qui vous permettraient de mieux vivre cette situation délicate.
Tel du service : 03 69 55 34 45
03 69 55 34 17
03 69 55 34 44
03 69 55 34 59
Astreinte : 06 68 53 94 32
Mail : Romain Favre :

Anne-Sophie Weingertner :

Nicolas Sananes :

Bibliographie.
1. Senat MV, Deprest J, Boulvain M, Paupe A, Winer N, Ville Y. Endoscopic laser surgery versus serial amnioreduction for severe twin-to-twin transfusion syndrome. N.Engl.J.Med. 2004;351:136-44.
2. Lewi L, Jani J, Cannie M, Robyr R, Ville Y, Hecher K et al. Intertwin anastomoses in monochorionic placentas after fetoscopic laser coagulation for twin-to-twin transfusion syndrome: is there more than meets the eye? Am.J.Obstet.Gynecol. 2006;194:790-95.
3. Robyr R, Lewi L, Salomon LJ, Yamamoto M, Bernard JP, Deprest J et al. Prevalence and management of late fetal complications following successful selective laser coagulation of chorionic plate anastomoses in twin-to-twin transfusion syndrome. Am.J.Obstet.Gynecol. 2006;194:796-803.
4. Yamamoto M, El Murr L, Robyr R, Leleu F, Takahashi Y, Ville Y. Incidence and impact of perioperative complications in 175 fetoscopy-guided laser coagulations of chorionic plate anastomoses in fetofetal transfusion syndrome before 26 weeks of gestation. Am.J.Obstet.Gynecol. 2005;193:1110-16.
5. Lopriore E, Middeldorp JM, Oepkes D, Klumper FJ, Walther FJ, Vandenbussche FP. Residual anastomoses after fetoscopic laser surgery in twin-to-twin transfusion syndrome: frequency, associated risks and outcome. Placenta 2007;28:204-08.
6. Lopriore E, van den Wijngaard JP, Middeldorp JM, Oepkes D, Walther FJ, van Gemert MJ et al. Assessment of feto-fetal transfusion flow through placental arterio-venous anastomoses in a unique case of twin-to-twin transfusion syndrome. Placenta 2007;28:209-11.
7. Baschat AA, Ty-Torredes K, miller J, Adams L, Harman CR. Fetoscopic laser ablation for twin twin transfusion syndrome – outcomes with a modified technique. Am.J.Obstet.Gynecol. 2008;6.
8. Lopriore E, Middeldorp JM, Sueters M, Vandenbussche FP, Walther FJ. Twin-to-twin transfusion syndrome: from placental anastomoses to long-term neurodevelopmental outcome. Curr.Pediatr.Rev. 2005;1:191-203.
9. Middeldorp JM, Sueters M, Lopriore E, Klumper FJ, Oepkes D, Devlieger R et al. Fetoscopic laser surgery in 100 pregnancies with severe twin-to-twin transfusion syndrome in the Netherlands. Fetal Diagn.Ther. 2007;22:190-94.
10. Lopriore E, Wezel-Meijler G, Middeldorp JM, Sueters M, Vandenbussche FP, Walther FJ. Incidence, origin, and character of cerebral injury in twin-to-twin transfusion syndrome treated with fetoscopic laser surgery. Am.J.Obstet.Gynecol. 2006;194:1215-20.
11. Lopriore E, Middeldorp JM, Oepkes D, Kanhai HH, Walther FJ, Vandenbussche FP. Twin anemia-polycythemia sequence in two monochorionic twin pairs without oligo-polyhydramnios sequence. Placenta 2007;28:47-51.
12. Lopriore E, Slaghekke F, Oepkes D, Middeldorp JM, Vandenbussche FPHA, Walther FJ. Hematological characteristics in neonates with twin anemia-polycythemia sequence. Prenat.Diagn. 2009.
13. Lopriore E, Sueters M, Middeldorp JM, Oepkes D, Vandenbussche FP, Walther FJ. Neonatal outcome in twin-to-twin transfusion syndrome treated with fetoscopic laser occlusion of vascular anastomoses. J.Pediatr. 2005;147:597-602.
Protocole STT et TAPS (téléchargement)
 Site du CPDPN Strasbourg Alsace
Site du CPDPN Strasbourg Alsace